5.1. Elektrolītiskās disociācijas teorija
Šo tematu iesāksim ar eksperimentu.
Astoņās vārglāzēs ir ievietotas šādas vielas:
destilēts ūdens, ūdensvada ūdens, ciets NaCl, NaCl šķīdums, NaCl kausējums, cukura šķīdums, NaOH šķīdums un etanols.
Katrā vārglāzē ievieto ogles elektrodus, kas savienoti ar spuldzīti un pievienoti strāvas avotam. Spuldzīte kvēlos tikai tajā gadījumā, ja vārglāzē būs vide, kas spēj vadīt elektrisko strāvu elektriskā lauka ietekmē.
Animācija. Elektrovadītspēja 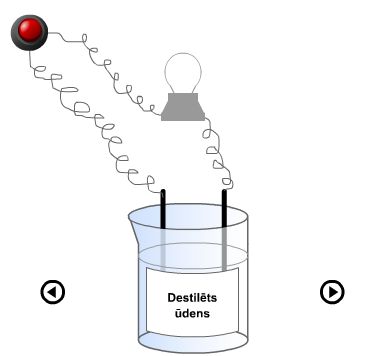
No dotā eksperimenta ir redzams, ka ir vielas, vielu šķīdumi un kausējumi, kas elektrisko strāvu vada vai nevada.
Vielas, kuru šķīdumi vai kausējumi vada elektrisko strāvu sauc par elektrolītiem, bet tās, kuru šķīdumi vai kausējumi elektrisko strāvu nevada, sauc par neelektrolītiem.
Sāļu, sārmu un skābju ūdensšķīdumu spēju vadīt elektrisko stāvu izskaidro elektrolītiskās disociācijas teorija(Svante
Arrēniuss, 1887.). Teorijas pamatā bija pieņēmums, ka ūdensšķīdumā elektrolīti sadalās (disociē) lādētās daļiņās – jonos. Līdzīgā veidā joni veidojas arī elektrolītu kausējumos. Procesu, kurā elektrolīti ūdensšķīdumos vai kausējumos sadalās jonos, sauc parelektrolītisko disociāciju.
Elektrolītiskās disociācijas teorijas pamattēzes
1. Elektrolīti, ja tos šķīdina ūdenī vai izkausē, sadalās (disociē) pretēji lādētos jonos.
Pozitīvos jonus sauc par katjoniem, negatīvos - par anjoniem. Ūdensšķīdumos joni ir hidratēti (ķīmiski saistīti ar ūdens molekulām). Elektrolītiskās disociācijas procesu vienkāršoti attēlo ar disociācijas vienādojumiem:
NaCl → Na++Cl-
HCl → H++Cl-

Animācija. NaCl šķīšana ūdenī.
2. Joni atšķiras no atomiem gan pēc uzbūves, gan arī pēc īpašībām.
Metāla nātrija gabaliņš
 |
|
Nātrija hlorīda kristāli
 |
| Na0 |
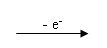 |
Na+ |
| 1s2 2s2 2p6 3s1 |
|
1s2 2s2 2p6 3s0 |
3. Elektrolītu šķīdumos vai kausējumos joni kustas haotiski. Ja šķīdumā vai kausējumā ievieto elektrodus, kas pieslēgti līdzstrāvas avotam, tad katjoni virzās uz katoda pusi, bet anjoni virzās uz anoda pusi. Pie elektrodiem joni izlādējas: katjoni no katoda saņem elektronus, bet anjoni elektronus atdod anodam. Joni pārvēršas elektriski neitrālos atomos vai molekulās.
· Skābes ir elektrolīti, kas, ūdensšķīdumos disociē, kā vienīgos katjonus veidojot ūdeņraža jonus:
HCl → H++Cl-
· Sārmi ir elektrolīti, kas, ūdensšķīdumā vai kausējumā disociējot, kā vienīgos anjonus veidojot hidroksīdjonus:
NaOH → Na++OH-
· Normālie sāļi ir elektrolīti, kas, ūdensšķīdumā vai kausējumā disociē pozitīvos metāla jonos un negatīvos skābes atlikuma jonos.
NaCl → Na++Cl-
4.Elektrolītu disociācija ir apgriezenisks process. Disociācijai pretējo procesu sauc par asociāciju (savienošanās).
Disociācijas pakāpes α skaitliskā vērtība rāda, cik liela elektrolīta daļa ir disociējusi jonos. Pēc disociācijas pakāpes lieluma elektrolītus iedala stiprajos, vājos un vidēji stipros elektrolītos.
Elektrolītu iedalījums
1.tabula
| Stiprie elektrolīti (α>30%) |
Vidēji stiprie elektrolīti (5%<α<30%) |
Vājie elektrolīti (α<5%) |
| Vielas formula |
α |
Vielas formula |
α |
Vielas formula |
α |
|
HCl
HNO3
NaOH
Ca(OH)2
KCl
|
78,6 %
82 %
73 %
90 %
~90 %
|
HF
H3PO4
|
7 %
17 %
|
H2S
H2CO3
CH3COOH
NH4OH
|
0,07 %
0,17 %
0,4 %
0,4 %
|