4.6.Oksīdu īpašību maiņa atkarībā no oksīdu veidojošo ķīmisko elementu vietas periodiskajā tabulā.
Gandrīz visi ķīmiskie elementi veido oksīdus. Oksīdi ir binārie savienojumi, kuros skābeklis savienots ar mazāk elektronegatīvu elementu. Elementu un to veidoto savienojumu īpašības atrodas periodiskā atkarībā no to vietas ķīmisko elementu periodiskajā tabulā.
Piemērs. 3. perioda elementi un to veidoto oksīdu īpašības
3.tabula
| Elementi |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
|
Elementi ar izteiktām metāliskām īpašībām
|
Elementi ar izteiktām nemetāliskām īpašībām
|
|
Oksīdi |
Na2O |
MgO |
Al2O3 |
SiO2 |
P2O5
P2O3 |
SO3
SO2 |
Cl2O7
Cl2O |
|
Bāziskie oksīdi
Bāziskos oksīdus veido tipiski metāli un pārejas elementi.
Ja pārejas elementiem ir raksturīgas vairākas oksidēšanās pakāpes,
tad pie bāziskajiem oksīdiem pieder oksīds ar zemāko oksidēšanas pakāpi.
|
Amfotērie oksīdi
Par amfotērajiem oksīdiem sauc oksīdus, kas spēj reaģēt gan ar skābēm, gan ar bāzēm, veidojot sāļus
|
Skābie oksīdi
Skābos oksīdus veido nemetāli un tie pārejas elementi, kuru oksidēšanas pakāpe savienojumos ir lielāka par +4.
| |
Ķīmiskās
īpašības |
Reaģē ar
ūdeni
MgO + H2O
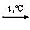 Mg(OH)2
Mg(OH)2
skābēm
MgO+ H2SO4→ MgSO4+ H2O
skābajiem oksīdiem
MgO + CO2 → MgCO3
|
Reaģē ar
skābēm
Al2O3+ 3H2SO4 → Al2(SO4)3 + 3H2O
bāzēm
Al2O3+ 2NaOH 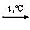 2NaAlO2 + H2O 2NaAlO2 + H2O |
Reaģē ar
ūdeni
SO2 + H2O → H2SO3
bāzēm
P2O5 +6NaOH → 2Na3PO4+ 3H2O
bāziskajiem oksīdiem
CO2 + CaO → CaCO3 |